台灣特有藥用菇蕈牛樟芝安全性試驗文獻回顧
民國103年4月號
台灣特有藥用菇蕈牛樟芝安全性試驗文獻回顧
一、前言
牛樟芝 (學名Antrodia cinnamomea),又名牛樟菇、樟菇、樟芝、窟內菰、神明菇等,是台灣特有的藥用真菌,分類學上屬於多孔菌科 (Polyporaceae) 薄孔菌屬 (Antrodia)。牛樟芝生長在高海拔的常綠闊葉喬木牛樟樹 (Cinnamomumkanehirae) 的心材内壁或是枯死倒伏之牛樟木材的潮濕表面,外型呈片狀、板狀或鐘狀,表面呈現紅色。
中國傳統中醫藥典籍並無關於牛樟芝的相關記錄,而在臺灣最早是由中國醫藥大學邱年永老師所記載:「氣芳香,味辛苦,有袪風行氣、化瘀活血、溫中消積、解毒消腫、鎮静止痛、抗菌、抗病毒、抗腫瘤之效;治胃腸疼痛,腹瀉嘔吐,食物中毒,毒蕈中毒,糖尿病、腎臟炎、尿蛋白、尿毒症、肝硬化、肝癌、流行性感冒、中暑、暈車」。台灣的原住民習用牛樟芝作為解酒、解宿醉之用。
截至2014年3月止,在PubMed文獻資料庫以牛樟芝的學名Antrodia cinnamomea作為關鍵字,一共可搜尋到58篇文獻,其中關於安全性試驗的文獻報告有4篇 [1-4]。分別是陳等人於2011年發表在Food and Chemical Toxicology探討牛樟芝口服亞慢性毒性研究 [1]、吳等人2011年發表在In Vivo探討牛樟芝基因毒性的研究 [2]、陳等人2011年發表在International Journal of Medicinal Mushrooms關於牛樟芝的發育毒性研究 [3]、以及Chang等人2013年發表在In Vivo進行牛樟芝在BALB/c小鼠的毒理研究 [4]。
本文將針對牛樟芝的安全性試驗報告進行文獻回顧,包括口服亞慢性毒性、致突變毒性以及胚胎發育毒性。
二、牛樟芝的安全性試驗文獻回顧
2011年由陳等人針對發酵培養牛樟芝菌絲體進行90天口服亞慢性毒性測試,研究結果發表在知名毒理學期刊Food and Chemical Toxicology [1]。實驗設計遵照Organization for Economic Co-operation and Development (OECD) Guideline 408:囓齒動物90天口服毒性試驗之方法 [5],作者以發酵培養得到的牛樟芝 (AntrodiacinnamomeaT. T. Chang & W. N. Chou; BCRC 35398) 紅棕色菌絲體,冷凍乾燥後研磨成粉末;實驗動物為9週齡的Sprague-Dawley (SD) 大鼠,每天以胃管餵食實驗動物高劑量 (3000毫克/公斤體重)、中劑量(2200毫克/公斤體重)、以及低劑量 (1500毫克/公斤體重) 牛樟芝,每組動物數目為雌雄各10隻。在90天的實驗期間,每天記錄體重、並於實驗前後進行視光學檢查。餵食90天後犧牲動物採血進行血清生化值分析以及組織病理學觀察。
血清生化值分析項目包括:天門冬胺酸轉胺酶 (Aspartate aminotransferase; AST)(U/L)、丙胺酸轉胺酶 (Alamine aminotransferase, ALT) (U/L)、鹼性磷酸酶 (Alkaline phosphatase, ALP) (U/L)、總膽紅素 (Total bilirubin, mg/dL)、麩胺酸轉胜酶 (gamma-glutamyl transferase, γ-GT) (U/L)、總蛋白 (Total protein, T. protein) (g/dL)、白蛋白 (Albumin) (g/dL)、球蛋白 (Globulin) (g/dL)、血清尿素氮 (Blood urea nitrogen, BUN) (mg/dL)、肌酐酸 (Creatinine) (mg/dL)、葡萄糖 (Glucose) (mg/dL)、三酸甘油酯 (Triglyceride) (mg/dL)、膽固醇 (Cholesterol) (mg/dL)、鈉離子 (Sodium) (meq/L)、鉀離子 (Potassium) (meq/L)、鈣離子 (Calcium) (meq/L)、氯離子 (Chloride) (meq/L) 以及磷離子 (Phosphorus) (mg/dL)。
記錄各種臟器重量,包括:腦、心臟、腎臟、肝臟、脾臟、腎上腺、睪丸、卵巢;病理學觀察是將組織切片以H&E染色後觀察,包括:腦、心臟、腎臟、肝臟、脾臟、腎上腺、睪丸、卵巢、子宮、骨髓、十二指腸、空腸、迴腸、盲腸、大腸、眼、食道、乳腺、哈氏腺、氣管、肺、淋巴結、胰臟、坐骨神經、腦下垂體、攝護腺、唾腺、皮膚、脊柱、胃、大腿肌肉、胸腺、甲狀腺與副甲狀腺、膀胱以及主動脈。實驗結果顯示,餵食牛樟芝菌絲體粉末的所有實驗動物組體重穩定增加,攝食情形也與控制組 (未餵食菌絲體粉末) 無差異,顯示動物在實驗期間穩定成長 (如圖1)。
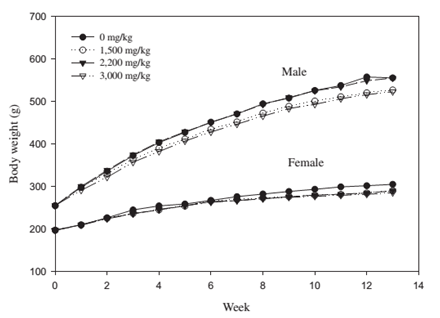
圖1 牛樟芝分析圖 90天口服安全性試驗期間,大鼠的體重變化圖 (引用自 [1] Figure 1)。
血液學檢查結果,有兩個指數在餵食牛樟芝菌絲體粉末後有明顯變化;即餵食高劑量牛樟芝菌絲體的雄性大鼠,平均血紅素corpuscular hemoglobin (MCH) 值明顯高於控制組;而餵食低與中劑量牛樟芝菌絲體的雌鼠,血小板的數目與控制組相比也有明顯增加。關於這兩項數值的變化,作者認為並不是同時發生在雌性與雄性大鼠,且不具劑量效益,因此作者沒有對血液學檢查的結果多加解釋。
而血清生化分析的結果 (表1、2),高劑量組雄性大鼠血清尿素氮 (BUN) 明顯低於控制組,而在低、中劑量組,肌酐酸 (creatinine) 顯著上升。血清尿素氮是臨床上最常用於評估腎功能的指標之一。一般而言,BUN濃度過高代表腎臟無法順利將尿素氮排出體外;而肌肝酸是另一用於評估腎功能的指標,可以代表腎絲球的過濾速度。另外,餵食低劑量牛樟芝的雄性大鼠膽固醇的數值顯著下降,而餵食中劑量的雌鼠膽固醇的數值則顯著性增加。由於血清尿素氮、肌酐酸以及膽固醇的變化並沒有同時出現在雌雄大鼠,也沒有劑量效益;根據OECD 408的標準,本篇研究結果的血清尿素氮、肌酐酸以及膽固醇數值均在標準數值範圍。
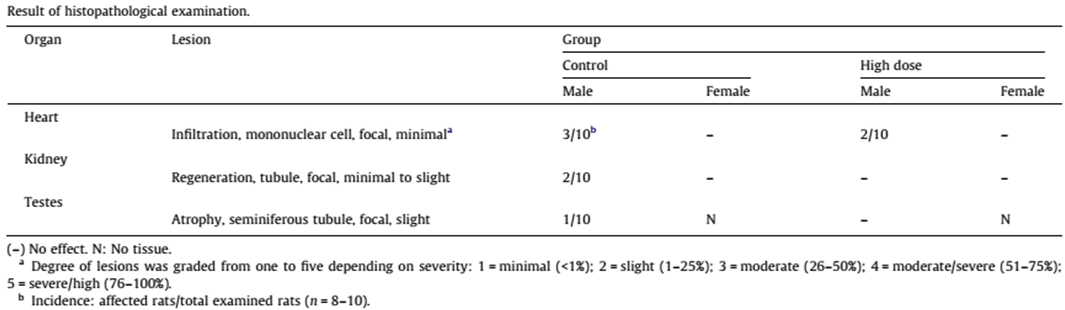
病理組織學的檢查結果 (表3),餵食中劑量的雌鼠,心臟的重量明顯下降。控制組與餵食高劑量的雄性大鼠,心臟切片有觀察到單核細胞浸潤,發生率分別為控制組:3/10;高劑量雄性大鼠2/10。在腎臟的部分,控制組當中有兩隻雄性實驗動物有觀察到腎小管再生。
表1 90天口服安全性試驗後,雄性SD大鼠的血清生化分析值 (引用自 [1] Table 1)。
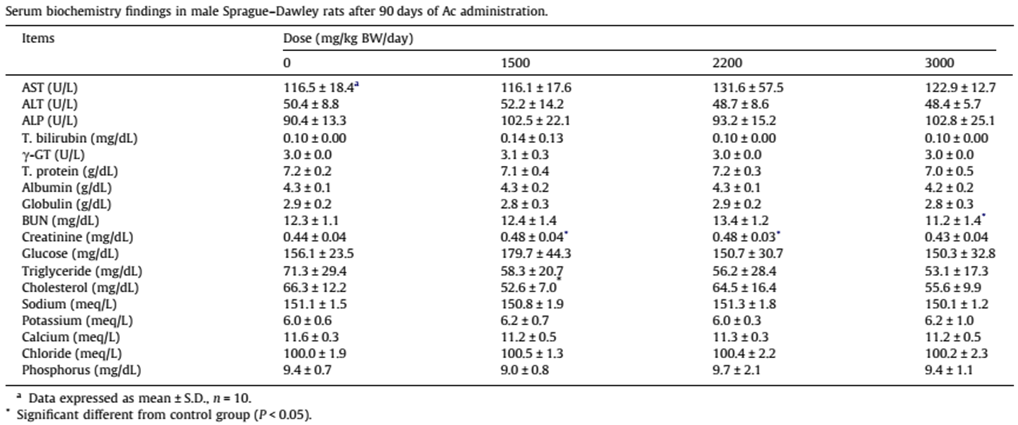
表2 90天口服安全性試驗後,雌性SD大鼠的血清生化分析值 (引用自 [1] Table 2)。
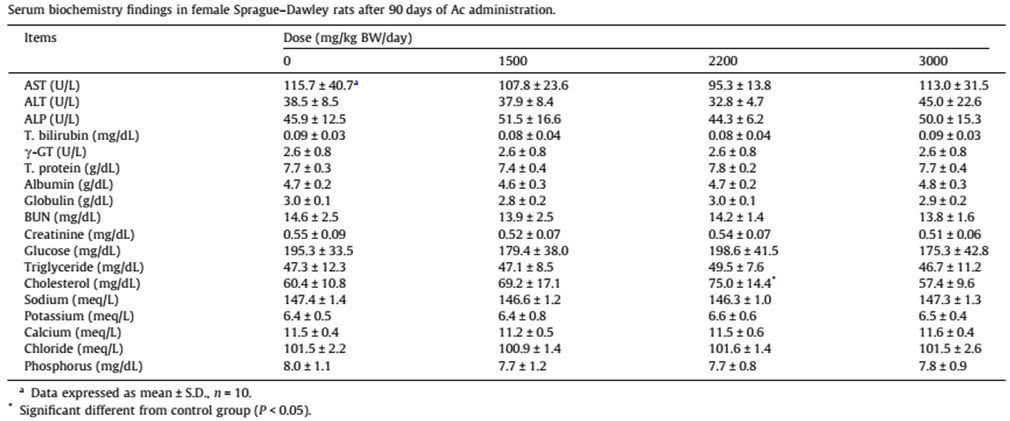
表3 90天口服安全性試驗後,大鼠的病理分析結果(引用 [1] Table 3)。
本研究在犧牲前一天,作者以代謝籠進行16小時的尿液收集,觀察分析項目包括:specific gravity (SG)、尿液顏色、尿蛋白、尿膽素原 (urobilinogen)、酸鹼值、ketone、bilirubin、葡萄糖、nitrite以及尿潛血。同時以顯微鏡觀察尿液抹片中白血球、紅血球、表皮細胞、結晶以及是否有微生物在其中。然而,本篇文獻當中,作者並沒有呈現尿液檢查的結果。另外,視光學檢查的結果也沒有呈現在本篇文獻報告中,均以「沒有異常」表示。
本篇研究結果顯示牛樟芝菌絲體口服90天亞急性毒性測試的結果顯示,牛樟芝菌絲體不會造成實驗動物系統性毒性,對於各器官系統也沒有觀察到毒性反應,因此作者由實驗結果認定牛樟芝菌絲體,對於大鼠的no-observed-adverse-effect level (NOAEL) 超過3000毫克/公斤體重。
吳等2011年發表於In Vivo期刊的報告 [2],探討牛樟芝的基因毒性。以Ames test測試牛樟芝致突變能力,並以中國倉鼠卵巢細胞 (Chinese hamster ovary cells; CHO) 分析牛樟芝對於染色體結構是否有影響。
本研究使用的沙門氏菌株為TA97 (ΔuvrB/rfa/ pKM101)、TA98 (ΔuvrB/rfa/ pKM101)、TA100 (ΔuvrB/rfa/ pKM101)、TA102 (rfa/pKM101)與TA1535 (ΔuvrB/rfa) 等5株菌株。將牛樟芝溶液 (3.125、6.25、12.5、25、50 毫克/毫升) 與肝代謝萃取液 (S9) 混合後,加入沙門氏菌培養基。致突變的正對照組,在有S9萃取液的條件下,TA98與TA102使用benzo[a]pyrene (1 μg/plate);TA97、TA100與TA1535使用2-aminoanthracene (4μg/plate)。不加入S9的條件下,TA97與TA98使用4-nitroquinoline-N-oxide (0.5 μg/plate)、TA102使用mitomycin C (0.5 μg/plate),TA100與TA1535使用sodium azide(4 μg/plate)。
致突變能力評估方法遵照Guide for the Salmonella typhimurium/mammalian microsome tests for bacterial mutagenicity [6]。染色體結構變異分析使用CHO細胞,評估方法參考Guidelines For Cytogenetic Studies on Human Populations Exposed to Mutagenic and Reproductive Hazards [7]以及世界衛生組織公布的方法 [8]。根據作者的實驗結果,牛樟芝 (3.125-50毫克/毫升) 在Ames test的結果為陰性,表示不具有致突變能力。
而體外染色體結構變異試驗的結果顯示,牛樟芝 (3.125-50毫克/毫升) 在所有的測試條件、以及代謝活化前後與不同時間處理下,對於中國倉鼠卵巢細胞引發染色體異常頻率並無顯著增加,因此判定結果為陰性反應,表示牛樟芝不會使得染色體異常頻率增加。因此作者總結牛樟芝對於沙門氏菌不具有致突變力,對於中國倉鼠卵巢細胞也不影響染色體異常頻率,因此牛樟芝的基因毒性測試均為陰性。
表4 牛樟芝進行Ames test的實驗結果 (引用自 [2] Table 1)。
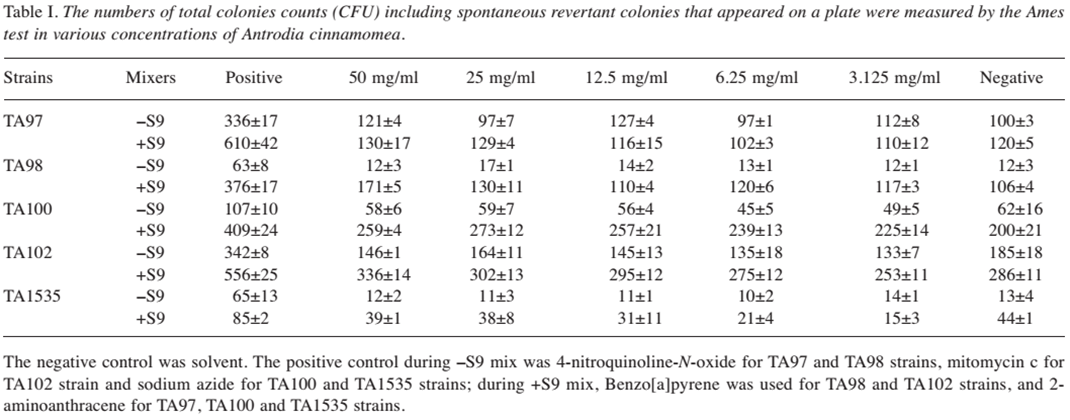
本篇研究的目的在於探討牛樟芝的致突變毒性;不過,文章當中在材料方法的部分,作者並沒有說明研究所使用的牛樟芝來源 (來自哪個菌種中心或是野外採集)、種類與部位 (子實體或是菌絲體) 以及製備方法 (研磨成粉末或是經過溶劑萃取)。
而關於牛樟芝菌絲體是否導致發育毒性的毒理研究,陳等人2011年在International Journal of Medicinal Mushrooms發表研究結果,探討發酵培養得到牛樟芝 (Antrodiacinnamomea, BCRC 35398) 菌絲體,冷凍乾燥再經研磨的菌絲體粉末對於胚胎發育是否具有毒性 [3]。
實驗方法遵照Organization for Economic Co-operation and Development (OECD) Guideline 414: Prenatal Developmental Toxicity Study [9]。實驗動物使用10-11週齡的Crl:CD (SD) 大鼠,母鼠交配懷孕後第6-15天,每天以餵食管餵食牛樟芝菌絲體,低劑量組50毫克/公斤體重、中劑量組150毫克/公斤體重、高劑量組500毫克/公斤體重,實驗期間記錄體重與攝食情形。
懷孕第20天,以剖腹的方式,取出子宮秤重紀錄,觀察並記錄每個卵巢當中黃體 (corpora lutea) 的數目、初期與後期再吸收胚胎的數目、存活與未存活胚胎數目與胚胎著床處數目。每個胚胎在秤重後、觀察紀錄是否有外觀異常,再以包氏液 (Bouin's solution) 固定,進行外觀與臟器觀察與胚胎性別判定。
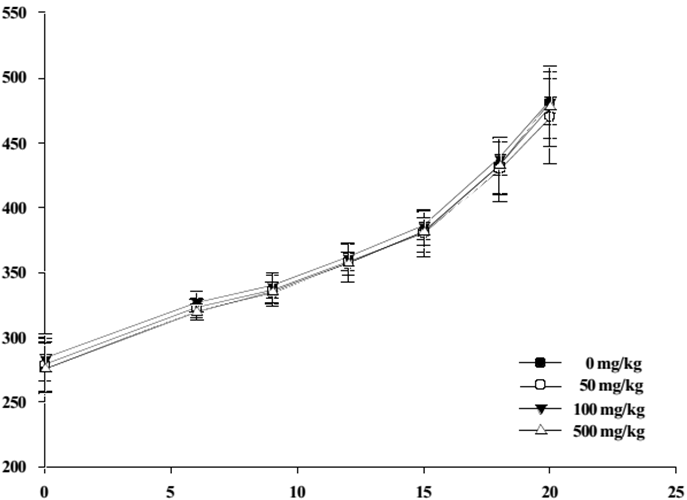
圖2 懷孕第0-20天母鼠體重變化圖 (引用自 [3] Figure 1)。
作者的研究結果顯示,餵食高、中、低劑量牛樟芝的懷孕母鼠體重與子宮的重量與控制組沒有顯著差異 (圖2),各組間的胚胎數目分別為、控制組:324、低劑量組:295、中劑量組:309、高劑量組:351,各組胚胎數目沒有統計上差異。另外,胚胎性別比值 (Fetal sex ratio, M/F) 各組間數據也沒有顯著差異 (表5),只有餵食中劑量組牛樟芝的大鼠,有一顆胚胎沒有存活。
其他妊娠指數,包括:子宮重量 (Gravid uterine weight)、黃體數目 (No. corpora lutea/dam)、胚胎著床處數目 (No. implantation sites/dam)、再吸收胚胎數目 (No. resorption/dam)、著床前死亡的胚胎數目 (Pre-implanation loss)、著床後死亡的胚胎數目 (Post-implanation loss) 等(前述指標請同時以中英文表示),在控制組與三個劑量的牛樟芝餵食組織間都沒有統計上差異 (表5)。因此作者認為牛樟芝在每日給予劑量500毫克/公斤體重以下對於懷孕大鼠不具有胚胎發育毒性。
表5 牛樟芝胚胎發育毒性試驗結果:妊娠指數 (引用自 [3] Table 1)。
Chang等人於2013年發表牛樟芝的毒理試驗報告,則是使用BALB/c小鼠進行牛樟芝萃取物亞慢性毒性試驗 [4]。研究方法與陳等2011年發表在Food and Chemical Toxicology的方法類似,一樣是90天口服試驗,每天餵食的劑量在低、中、高劑量組分別為16.67、833.3、1666.67 毫克/公斤體重,研究結果顯示所有餵食牛樟芝與控制組小鼠,體重、攝食情形、血液學檢查與血清生化值等均沒有顯著差異。因此作者認為,牛樟芝對於BALB/c小鼠90天亞慢性毒性測試的結果為陰性。
三、討論
根據以上4篇目前已發表的研究報告可知,口服牛樟芝在90天亞慢性毒性試驗對於SD大鼠 [1] 以及BALB/c小鼠 [4] 均不具毒性,同時以Ames test進行的致突變性試驗 [2],牛樟芝也不會造成沙門氏菌突變,另外牛樟芝對於胚胎也不具發育毒性 [3];以上研究結果對於牛樟芝的口服安全性提供了科學證據。另外,Wu等 [2]與Chang等 [4]的研究,沒有說明使用的牛樟芝來源;而陳等人研究中所使用的牛樟芝來源自台灣生物資源保存及研究中心,菌種編號為BCRC 35398。因此由陳等的研究[1,3]可以證明牛樟芝 (Antrodia cinnamomea T. T. Chang & W. N. Chou, BCRC 35398) 發酵菌絲體粉末的口服安全性。
目前台灣的市場上,宣稱為野生子實體的牛樟芝市場價格一兩約為8000~20000元,相當於每公克213~533元;部分廠商以椴木栽培得到的牛樟芝子實體產品,市場價格約為每公克120-525元。牛樟芝子實體的價格相當昂貴,可能是至目前為止,尚無牛樟芝子實體安全性研究報告的原因。另外,使用不同萃取方法得到的菌絲體或子實體萃取物,其安全性試驗報告也未見諸文獻。因此,更多的安全性試驗仍有待進行,以說明牛樟芝子實體、萃取物等之口服安全性。
參考文獻
1. Chen TI, Chen CC, Lin TW, Tsai YT, Nam MK.A 90-day subchronic toxicological assessment of Antrodiacinnamomea in Sprague-Dawley rats.Food ChemToxicol. 2011, 49:429-433.
2. Wu MF, Peng FC, Chen YL, Lee CS, Yang YY, Yeh MY, Liu CM, Chang JB, Wu RS, Yu CC, Lu HF, Chung JG.Evaluation of genotoxicity of Antrodiacinnamomea in the Ames test and the in vitro chromosomal aberration test.In Vivo. 2011, 25:419-423.
3. Chen TI, Chen CW, Lin TW, Wang DS, Chen CC.Developmental toxicity assessment of medicinal mushroom Antrodiacinnamomea T.T. Chang et W.N. Chou (higher Basidiomycetes) submerged culture mycelium in rats.Int J Med Mushrooms. 2011, 13: 505-511.
4. Chang JB, Wu MF, Lu HF, Chou J, Au MK, Liao NC, Chang CH, Huang YP, Wu CT, Chung JG. Toxicological evaluation of Antrodiacinnamomea in BALB/c mice. In Vivo. 2013, 27: 739-745.
5. Economic Co-operation and Development (OECD) Guideline 408: Repeated Dose 90-Day Oral Toxicity Study in Rodents. DOI :10.1787/9789264070707-en.
6. Claxton LD, Allen J, Auletta A, Mortelmans K, Nestmann E, Zeiger E. Guide for the Salmonella typhimurium/mammalian microsome tests for bacterial mutagenicity. Mutat Res 1987, 189: 83-91.
7. Archer PG, Bender M, Bloom A, Brewen J, Carano A, Preston R. Guidelines for cytogenetic studies in mutagenexposed human populations.In: Bloom AD (ed.). Guidelines ForCytogenetic Studies on Human Populations Exposed toMutagenic and Reproductive Hazards. March of dimes birthdefects foundation. 1981, pp. 1-35, 1981.
8. WHO: Guide to short-term tests for detecting mutageniccarcinogenic chemicals. Environmental Health Criteria 51.Geneva: World Health Organization. 1985, pp. 57-67.
9. Economic Co-operation and Development (OECD) Guideline414: Prenatal developmental toxicity study. DOI :10.1787/9789264070820-en.