六君子湯:一個具有潛力可用於輔助治療化療所引發神經毒之複方

一、前言
六君子湯出自宋朝之《太平惠民和劑局方》,迄今使用已逾千年,為常見的中藥複方,在日本則屬漢方並名為 Rikkunshito。按衛生福利部公告之基準方,其組成包含人參、白朮、茯苓、半夏、炙甘草、陳皮、生薑、大棗 (5:5:5:5:2.5:2.5:2.5:2.5)。該方有健脾益氣,燥濕化痰之功。主要用於治療脾胃氣虛兼有痰濕證,而面色萎白,語聲低微,氣短乏力,食少便溏,咳嗽痰多色白,噁心嘔吐,舌淡苔白膩,脈虛等之症。現代醫學則應用於治療妊娠嘔吐、肺氣腫、哮喘、慢性支氣管炎、腹瀉、胃炎及十二指腸潰瘍、慢性腸炎、胃下垂、胃弛緩等疾病。其中在腸胃道之調節功能已有相當多的科學研究與臨床驗證 [1-5],顯示六君子湯確有調理腸道之功能。目前已知其作用機轉可能與提昇飢餓素 (ghrelin) 的功能 [6,7] 以及拮抗血清素二型接受器 (serotonin type 2 receptor) [8,9] 有關。由於六君子湯具腸道之調節功能,六君子湯及其相關之複方遂被應用於治療化療所誘發之副作用 [10-13],如順鉑 (cisplatin) 所誘發之消化不良 [14] 與厭食性惡病質症等 [15]。另外,六君子湯及其相關之複方同樣被證明可以引發神經性與疼痛緩解之功能,如減緩憂鬱 [16] 與抑制腹痛 [1]。
化療藥敏克瘤 (vincristine),汰癌勝 (paclitaxel),益樂鉑 (oxaliplatin) 與順鉑所引發的周邊神經病變 (peripheral neuropathy) 是癌症治療時常見的神經性併發症 [17]。該神經毒性常導致患者之失能與生活品質下降。常見之症狀包含疼痛、燒灼、麻木、失覺、失衡等問題。疼痛的感覺包括類似槍擊或電擊般的痛、機械性或溫度性的異常性疼痛或痛覺過敏等 [18]。在這些治療藥物中,順鉑多年來是臨床常用於抗腫瘤的化療藥 [19],其抗癌機轉主要是與細胞核之 DNA 結合並破壞其螺旋結構導致轉譯抑制 [20] 與細胞凋亡 [21]。雖然順鉑導致如耳、腎、骨髓、腸胃道等毒性與細胞凋亡有關 [22,23],但順鉑如何導致周邊神經病變之機轉仍不清楚。除之前所提與細胞核之 DNA 螯合外,順鉑也會與粒線體之 DNA 與蛋白質結合並造成細胞凋亡 [24]。近年來粒線體之功能失衡被認為是順鉑在背根神經節造成細胞死亡之因素 [25] 與神經病變之機轉。因此,近年來粒線體功能在神經毒性之調節角色上被積極的研究著 [26,27]。
雖然六君子湯在減緩化療藥物所誘發腸胃道副作用的功能已有許多的研究支持,但是在神經性的與疼痛緩解方面的機轉研究則很少見。因此,本研究想要探討六君子湯可能潛在對抗順鉑所誘發神經毒性之機轉。
二、研究方法及結果
本研究首先利用順鉑在小鼠 (Balb/c) 進行造模 [28] 並給予餵食六君子湯 [29],並以閃尾實驗 (tail-flick assay) 測試老鼠對熱的敏感度。結果顯示,服用六君子湯可以反轉順鉑所導致小鼠熱敏感性 (圖一),代表六君子湯具有減緩順鉑所導致神經病變之潛力。
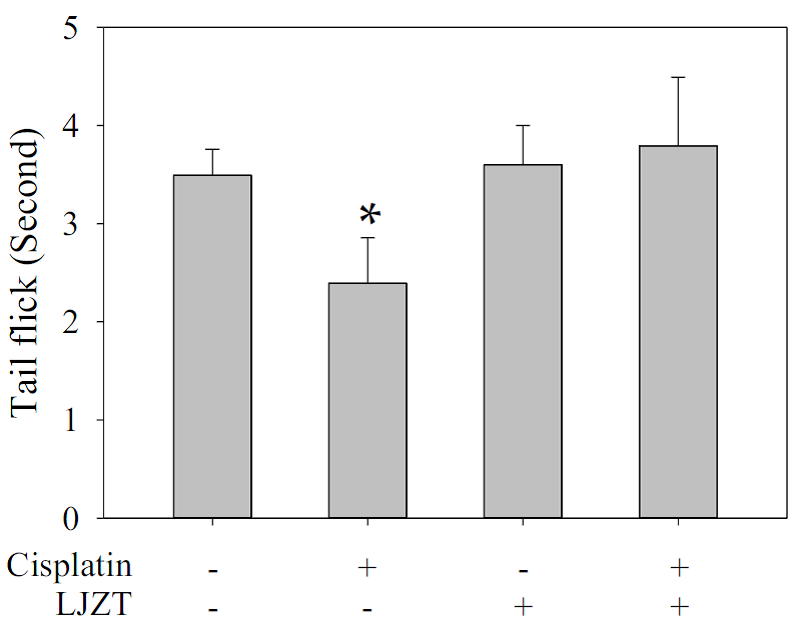
圖一:六君子湯 (LJZT) 可以反轉因順鉑 (cisplatin) 所造成小鼠閃尾測試(tail-flick) 時間之減少。
接下來以順鉑處理人類神經瘤母細胞 (neuroblastoma,SH-SY5Y) 作為一離體外模型。結果顯示,六君子湯 (LJZT) 具有減緩順鉑所導致該細胞之死亡 (圖二:A) 以及細胞凋亡之標記,如截切 (cleaved) 型態之 PARP 與 caspase 3 (圖二:B)。這顯示六君子湯可能具有神經保護作用可以抑制順鉑所造成之細胞凋亡。
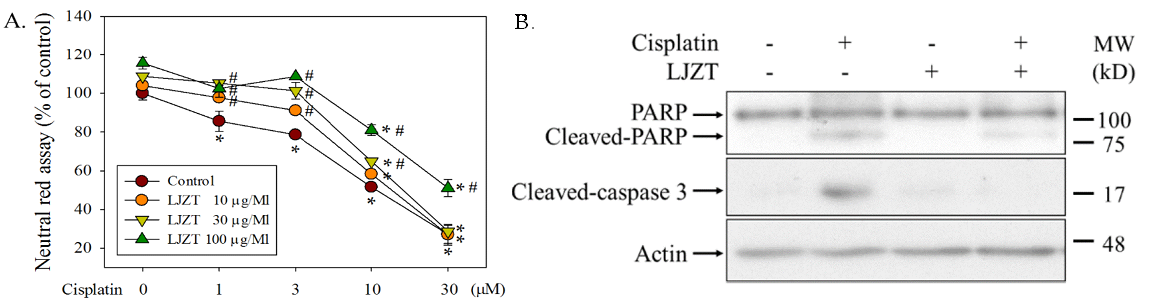
圖二:六君子湯 (LJZT) 減緩順鉑 (cisplatin) 所導致的細胞凋亡。
(A) 六君子湯可以反轉因順鉑所造成 SH-SY5Y 細胞的死亡;(B) 與截切型態之 PARP 與 caspase 3。
由於順鉑造成細胞凋亡可能與粒線體有關,所以進一步觀測順鉑對粒線體的影響。結果顯示六君子湯可以抑制順鉑所造成粒線體凋亡因子的釋放 (圖三),如 Cytochrome C、HtrA2/Omi、Smac/Diablo。這說明六君子湯對粒線體具有調節功能。
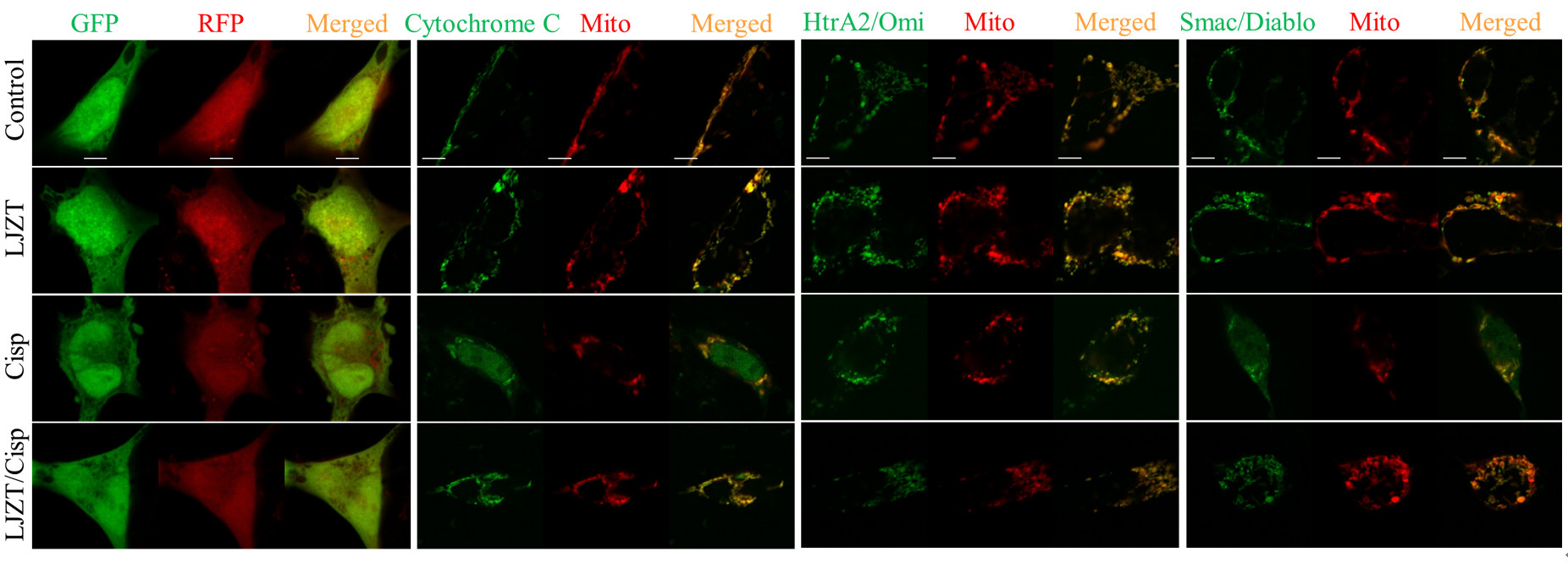
圖三:六君子湯 (LJZT) 減緩順鉑 (cisplatin) 所導致粒線體凋亡因子的釋放。
六君子湯抑制粒線體內 Cytochrome C、HtrA2/Omi、Smac/Diablo 轉移至細胞質。
由於粒線體的功能與生合成主要受到過氧化物酶體增殖物啟動受體γ輔啟動因子1 (peroxisome proliferator activated receptor gamma coactivator-1,PGC-1) 所調控,因此進一步探測該分子之表現。結果顯示,六君子湯似乎可以增加粒腺體的量並減緩順鉑所造成粒線體分裂的現象 (圖四:A左側),如果大量表現 PGC-1 則可顯著增加粒線體的量並減緩順鉑所造成粒線體分裂的現象 (圖四:A右側)。另外六君子湯也可阻斷順鉑所導致 PGC-1 表現量的下降 (圖四:B),這與六君子湯可以促進 PGC-1 啟動子有關 (圖四:C)。所以六君子湯可能透過啟動 PGC-1 的表現來增加粒線體的生合成並阻斷順鉑所導致粒線體的斷裂。
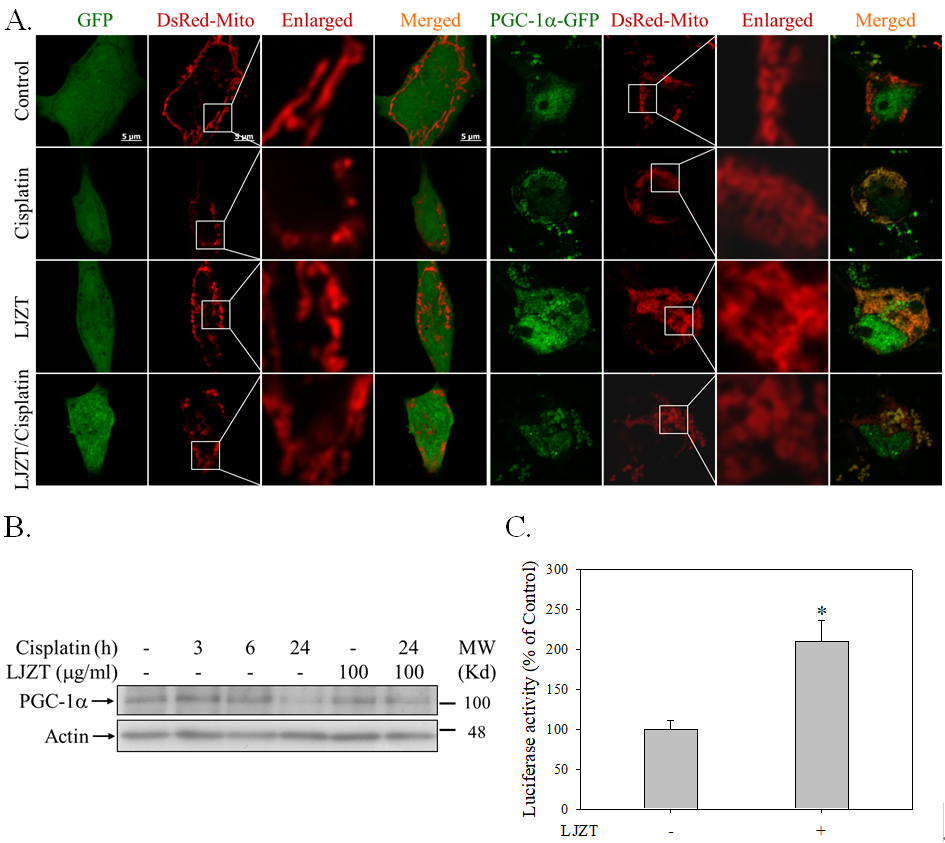
圖四:六君子湯 (LJZT) 與 PGC-1 對抗順鉑之毒性。
(A) 六君子湯減緩順鉑所導致粒線體的分裂,而大量表現 PGC-1 則可增加粒線體的量並減緩順鉑所導致粒線體的分裂;
(B) 六君子湯減緩順鉑所導致 PGC-1 的表現量下降;(C) 六君子湯促進 PGC-1 啟動子的活性。
三、討論
六君子湯原本具有健脾益氣,燥濕化痰之功,然而現代研究顯示該方在化療所誘發食慾不振或腸道損傷等之輔助治療具其應用性。本研究更進一步指出,六君子湯具有減緩化療所引發神經病變之潛力,其機轉可能與調控粒線體的功能與生合成有關。
參考文獻
[1] Xiao Y, Liu YY, Yu KQ, Ouyang MZ, Luo R, Zhao XS. Chinese herbal medicine liu jun zi tang and xiang sha liu jun zi tang for functional dyspepsia: meta-analysis of randomized controlled trials. Evid Based Complement Alternat Med. 2012;2012:936459.
[2] Tatsuta M, Iishi H. Effect of treatment with liu-jun-zi-tang (TJ-43) on gastric emptying and gastrointestinal symptoms in dyspeptic patients. Aliment Pharmacol Ther. 1993;7(4):459-462.
[3] Kawahara H, Kubota A, Hasegawa T, et al. Effects of rikkunshito on the clinical symptoms and esophageal acid exposure in children with symptomatic gastroesophageal reflux. Pediatr Surg Int. 2007;23(10):1001-1005.
[4] Nahata M, Saegusa Y, Sadakane C, et al. Administration of exogenous acylated ghrelin or rikkunshito, an endogenous ghrelin enhancer, improves the decrease in postprandial gastric motility in an acute restraint stress mouse model. Neurogastroenterol Motil. 2014;26(6):821-831.
[5] Matsumura T, Arai M, Yonemitsu Y, et al. The traditional Japanese medicine Rikkunshito increases the plasma level of ghrelin in humans and mice. J Gastroenterol. 2010;45(3):300-307.
[6] Takeda H, Muto S, Nakagawa K, Ohnishi S, Asaka M. Rikkunshito and ghrelin secretion. Current pharmaceutical design. 2012;18(31):4827-4838.
[7] Takeda H, Sadakane C, Hattori T, et al. Rikkunshito, an herbal medicine, suppresses cisplatin-induced anorexia in rats via 5-HT2 receptor antagonism. Gastroenterology. 2008;134(7):2004-2013.
[8] Fujitsuka N, Asakawa A, Hayashi M, et al. Selective serotonin reuptake inhibitors modify physiological gastrointestinal motor activities via 5-HT2c receptor and acyl ghrelin. Biol Psychiatry. 2009;65(9):748-759.
[9] Arai T, Maejima Y, Muroya S, Yada T. Rikkunshito and isoliquiritigenin counteract 5-HT-induced 2C receptor-mediated activation of pro-opiomelanocortin neurons in the hypothalamic arcuate nucleus. Neuropeptides. 2013;47(4):225-230.
[10] Ohnishi S, Takeda H. Herbal medicines for the treatment of cancer chemotherapy-induced side effects. Front Pharmacol. 2015;6:14.
[11] Chao TH, Fu PK, Chang CH, et al. Prescription patterns of Chinese herbal products for post-surgery colon cancer patients in Taiwan. J Ethnopharmacol. 2014;155(1):702-708.
[12] Lam W, Bussom S, Guan F, et al. The four-herb Chinese medicine PHY906 reduces chemotherapy-induced gastrointestinal toxicity. Sci Transl Med. 2010;2(45):45ra59.
[13] Qi F, Zhao L, Zhou A, et al. The advantages of using traditional Chinese medicine as an adjunctive therapy in the whole course of cancer treatment instead of only terminal stage of cancer. Biosci Trends. 2015;9(1):16-34.
[14] Zhang QY, Wang FX, Jia KK, Kong LD. Natural Product Interventions for Chemotherapy and Radiotherapy-Induced Side Effects. Front Pharmacol. 2018;9:1253.
[15] Fujitsuka N, Uezono Y. Rikkunshito, a ghrelin potentiator, ameliorates anorexia-cachexia syndrome. Front Pharmacol. 2014;5:271.
[16] Xie M. Modern Study of the Medical Formulae in Traditional Chinese Medicine (Volume 1). Vol 1. Beijing: Beijing Xue Yuan Press; 1997.
[17] Esin E, Yalcin S. Neuropathic cancer pain: What we are dealing with? How to manage it? Onco Targets Ther. 2014;7:599-618.
[18] Starobova H, Vetter I. Pathophysiology of Chemotherapy-Induced Peripheral Neuropathy. Front Mol Neurosci. 2017;10:174.
[19] Lippard SJ. New chemistry of an old molecule: cis-[Pt(NH3)2Cl2]. Science. 1982;218(4577):1075-1082.
[20] Jung Y, Lippard SJ. Direct cellular responses to platinum-induced DNA damage. Chem Rev. 2007;107(5):1387-1407.
[21] Eastman A. Activation of programmed cell death by anticancer agents: cisplatin as a model system. Cancers Cells. 1990;2(8-9):275-280.
[22] Barabas K, Milner R, Lurie D, Adin C. Cisplatin: a review of toxicities and therapeutic applications. Vet Comp Oncol. 2008;6(1):1-18.
[23] Karasawa T, Steyger PS. An integrated view of cisplatin-induced nephrotoxicity and ototoxicity. Toxicol Lett. 2015;237(3):219-227.
[24] Yang Z, Schumaker LM, Egorin MJ, Zuhowski EG, Guo Z, Cullen KJ. Cisplatin preferentially binds mitochondrial DNA and voltage-dependent anion channel protein in the mitochondrial membrane of head and neck squamous cell carcinoma: possible role in apoptosis. Clin Cancer Res. 2006;12(19):5817-5825.
[25] McDonald ES, Windebank AJ. Cisplatin-induced apoptosis of DRG neurons involves bax redistribution and cytochrome c release but not fas receptor signaling. Neurobiol Dis. 2002;9(2):220-233.
[26] Pareyson D, Piscosquito G, Moroni I, Salsano E, Zeviani M. Peripheral neuropathy in mitochondrial disorders. Lancet Neurol. 2013;12(10):1011-1024.
[27] Bindu PS, Govindaraju C, Sonam K, et al. Peripheral neuropathy in genetically characterized patients with mitochondrial disorders: A study from south India. Mitochondrion. 2016;27:1-5.
[28] Ta LE, Low PA, Windebank AJ. Mice with cisplatin and oxaliplatin-induced painful neuropathy develop distinct early responses to thermal stimuli. Mol Pain. 2009;5:9.
[29] Chiou CT, Wang KC, Yang YC, et al. Liu Jun Zi Tang-A Potential, Multi-Herbal Complementary Therapy for Chemotherapy-Induced Neurotoxicity. Int J Mol Sci. 2018;19(4):pii:E1258. doi: 10.3390/ijms19041258.
作者:
衛生福利部國家中醫藥研究所 黃乃瑰 研究員

